Images
Participantes





Contact

Investigadores del CNIO y el IRB Barcelona desvelan el funcionamiento de las proteínas HAT, que sirven de compuertas para la entrada y salida de aminoácidos en las células.
Con la ayuda de la crio-microscopía electrónica, desvelan los mecanismos por los que unas proteínas HAT transportan unos aminoácidos concretos y no otros.
Estos resultados contribuyen a aclarar por qué los distintos HAT intervienen en unas enfermedades concretas como el cáncer, en unos casos, o en enfermedades neurológicas como el ictus, el Alzheimer o la sordera, en otros.
El gran reto de los investigadores ahora será intervenir sobre estas proteínas para hacer frente a estas enfermedades, que suponen un grave problema de salud pública.
Las proteínas de la familia HAT son esenciales para la vida - transportan aminoácidos a través de la membrana celular-. Sin embargo, siendo sus miembros prácticamente idénticos, unos transportan unos aminoácidos y otros no. Esta especialización es responsable de que cada uno de ellos esté involucrado en funciones concretas como, por ejemplo, el crecimiento celular o el funcionamiento de las neuronas y, por ende, en enfermedades relacionadas como el cáncer o las enfermedades neurodegenerativas como el Alzheimer.
¿Qué es lo que les confiere esta especificidad y diversidad de funciones? Es una de las preguntas que se plantearon los investigadores del Centro Nacional de Investigaciones Oncológicas (CNIO) y del Instituto de Investigación Biomédica (IRB Barcelona) que lideran este estudio, y cuya respuesta publica esta semana la revista Proceedings of the National Academy of Sciences (PNAS).
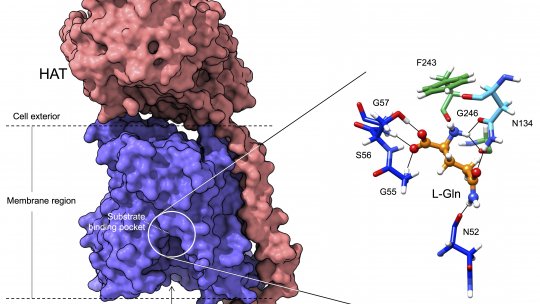
Gracias a las últimas tecnologías de alta resolución estructural como la criomicroscopía electrónica, los investigadores han sido capaces de visualizar con detalle atómico la estructura de uno de los miembros de esta familia de proteínas y, combinado con modelado computacional y el diseño de mutantes de la proteína, entender así su funcionamiento. Los resultados del estudio muestran que solo unos pocos residuos de esta familia de proteínas, situados en regiones muy concretas, seleccionan los aminoácidos específicos a los que se van a unir, y son por tanto los responsables de que desarrollen una función u otra.
Con esta información, el gran reto de los investigadores ahora es encontrar nuevas terapias y herramientas diagnósticas para patologías en las que están implicadas los transportadores de la familia HAT, con especial interés en aquellas enfermedades que representan graves problemas de salud pública como el cáncer o las enfermedades neurodegenerativas como el Alzheimer.
Conocer la forma para intervenir su función
Los aminoácidos, los ladrillos básicos que permiten la vida, entran y salen de las células para que estas puedan crecer, dividirse y desarrollar sus funciones fisiológicas. Esta entrada y salida de las células sucede gracias a las compuertas conformadas por, entre otras, las proteínas de la familia HAT, que se encuentran embebidas en las membranas de las células.
A pesar de que las proteínas HAT son prácticamente idénticas en su estructura, unas transportan unos aminoácidos y no otros, lo que les confiere funciones completamente distintas, como aquellas relacionadas con el crecimiento de las células y su implicación en enfermedades como el cáncer, el funcionamiento de las neuronas; o el transporte de sustancias tóxicas y su implicación en la adicción a sustancias como la cocaína.
Con la finalidad de entender esta especificidad en la función, los científicos se marcaron como objetivo estudiar la estructura tridimensional de esta importante familia de proteínas. “Las técnicas más tradicionales para la determinación de la estructura de proteínas como las que utilizan rayos X han tenido un éxito limitado con proteínas que están embebidas en las membranas biológicas, por lo que muchas preguntas han quedado sin resolver”, declara el Dr. Óscar Llorca, jefe del Grupo de Complejos Macromoleculares en la Respuesta a Daños en el DNA del CNIO, director del Programa de Biología Estructural del Centro y coautor del trabajo.
“La combinación de la resolución de la estructura por crio-microscopía electrónica con cálculos de dinámica molecular y estudios funcionales, supone una plataforma experimental con mucho potencial que permite desentrañar el funcionamiento de transportadores de aminoácidos. En este caso, hemos aplicado esta tecnología para la identificación de los mecanismos moleculares que hace que estas proteínas transporten unos aminoácidos y no otros”, afirma el Dr. Manuel Palacín, jefe del laboratorio de Transportadores de Aminoácidos y Enfermedad del IRB Barcelona, jefe de grupo en el CIBER de Enfermedades Raras, y Catedrático de la Universidad de Barcelona.
Nuevos fármacos contra el cáncer y el Alzheimer
Gracias a las técnicas de crio-microscopía electrónica, campo en el que el Dr. Llorca es un experto a nivel mundial, la visualización de la estructura molecular de proteínas ha dado un paso de gigante hacia lo que conocemos a día de hoy como la era dorada de las estructuras tridimensionales. Esta nueva tecnología, que se hizo con el Premio Nobel de Química en 2017, no solo ha servido para visualizar procesos biológicos como nunca antes se habían visto, sino que está también contribuyendo a acelerar el desarrollo de nuevos compuestos y fármacos de interés en la lucha contra el cáncer y otras enfermedades humanas.
En este trabajo los investigadores han sido capaces de visualizar con resolución atómica, mediante el uso de crio-microscopía electrónica, la estructura de un miembro de la familia HAT, y determinar el bolsillo donde se unen los aminoácidos que transportan así como el detalle del mecanismo por el que sucede este reconocimiento.
El detalle atómico desvela que solo unos pocos residuos de estas proteínas son responsables de dictar los aminoácidos a los que se unen y por tanto sus funciones específicas. Además, el trabajo demuestra cómo las sustituciones de unos residuos por otros en estas posiciones en los distintos miembros de la familia son responsables del cambio en la especificidad de reconocimiento y transporte de unos aminoácidos y no otros.
Los resultados de esta investigación permitirán dirigir ahora los esfuerzos a conseguir nuevos fármacos que actúen específicamente sobre regiones concretas de estas proteínas, y controlar las enfermedades en las que intervienen como el cáncer o enfermedades neurodegenerativas como el Alzheimer.
El trabajo, liderado por el IRB Barcelona y el CNIO, se ha llevado a cabo en colaboración con los grupos del Dr. Víctor Guallar, en el Barcelona Supercomputing Center (BSC) y la Dra. Lucía Díaz de la empresa biotecnológica Nostrum Biodiscovery.
El estudio ha sido posible gracias a la financiación de la Fundación “la Caixa”, que, a través de su programa CaixaResearch, impulsa las mejores iniciativas para hacer frente a la lucha contra las enfermedades que causan mayor impacto en el mundo, como son las cardiovasculares, neurológicas, infecciosas y oncológicas.
El proyecto también ha recibido financiación del Ministerio de Ciencia e Innovación, el Instituto de Salud Carlos III, Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER), el Fondo Europeo para el Desarrollo Regional y la Generalitat de Catalunya.
Artículo relacionado:
Carlos F Rodriguez*, Paloma Escudero-Bravo*, Lucía Díaz, Paola Bartoccioni, Carmen García-Martín, Joan G Gilabert, Jasminka Boskovic, Víctor Guallar, Ekaitz Errasti-Murugarren&, Oscar Llorca& and Manuel Palacín& (* co-primeros autores; & co- autores de correspondencia).
Structural basis for substrate specificity of heteromeric transporters of neutral amino acids
Proceedings of the Natural Academy of Science USA (2021) DOI: 10.1073/pnas.2113573118
IRB Barcelona
El Instituto de Investigación Biomédica (IRB Barcelona) trabaja para conseguir una vida libre de enfermedades. Desarrolla una investigación multidisciplinar de excelencia para curar el cáncer y otras enfermedades vinculadas al envejecimiento. Establece colaboraciones con la industria farmacéutica y los principales hospitales para hacer llegar los resultados de la investigación a la sociedad, a través de la transferencia de tecnología, y realiza diferentes iniciativas de divulgación científica para mantener un diálogo abierto con la ciudadanía. El IRB Barcelona es un centro internacional que acoge alrededor de 400 científicos de más de 30 nacionalidades. Reconocido como Centro de Excelencia Severo Ochoa desde 2011, es un centro CERCA y miembro del Barcelona Institute of Science and Technology (BIST).