Images
Participantes



Contact

Investigadores liderados por Natàlia Carulla encuentran los ensamblajes específicos de proteína beta-amiloide (Aβ), que tienen la capacidad de alterar la membrana de las neuronas, causando su muerte.
Los resultados han sido publicados en la revista Nature Communications.
El cerebro de millones de personas que padecen la enfermedad de Alzheimer se está vaciando lenta e inevitablemente de neuronas, lo que conduce a las características pérdida de memoria y de función cognitiva asociadas a esta enfermedad. Sin embargo, la causa de la muerte neuronal aún se desconoce. Los tratamientos disponibles tienen como objetivo retrasar el desarrollo de la demencia y solo contribuyen a mejorar la calidad de vida por cortos períodos de tiempo. Por lo tanto, los tratamientos para curar el Alzheimer son una necesidad médica no resuelta.
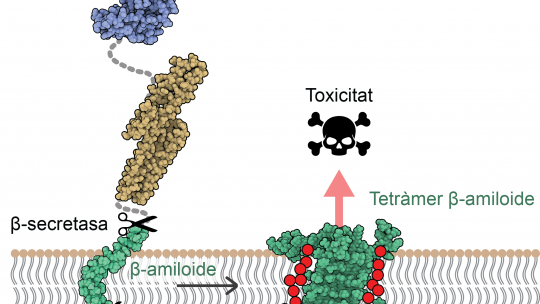
Investigadores liderados por Natàlia Carulla, alumni IRB Barcelona, anteriormente jefa de laboratorio en el Institut Européen de Chimie et Biologie (IECB) en Burdeos, y actualmente responsable de proyectos en Grup CIEF, han revelado por primera vez la estructura atómica de los ensamblajes de proteínas beta-amiloide (Aβ). El conocimiento de esta estructura revela un nuevo mecanismo de toxicidad para estos conjuntos, que tienen la capacidad de alterar la membrana neuronal, permitiendo que el agua y los iones pasen a través de ella y causando la muerte de estas células. Varios estudios han propuesto con anterioridad que la interacción de la proteína Aβ con la membrana neuronal es responsable de la muerte neuronal observada en el Alzheimer. Sin embargo, la proteína Aβ es un objetivo terapéutico difícil porque es "pegajosa" y se autoensambla, adoptando formas y tamaños distintos.
"Conocer las características de estos conjuntos de proteínas, como la cantidad de moléculas que los constituyen y la forma que adoptan, es crucial para diseñar estrategias terapéuticas efectivas que se dirijan a los ensamblajes de Aβ responsables de la neurotoxicidad en el Alzheimer", explica Carulla.
Una aproximación in vitro para garantizar formas estables de Aβ
Para abordar la inestabilidad de las diferentes conformaciones, el equipo primero estudió la proteína Aβ in vitro, en sistemas modelo simplificados que imitan la membrana neuronal, para obtener ensamblajes de Aβ estables, con composición y forma uniformes. Una vez que se identificaron las diferentes composiciones, estudiaron su estructura y modo de neurotoxicidad, estableciendo una disposición 3D de todos los átomos que forman el conjunto Aβ.
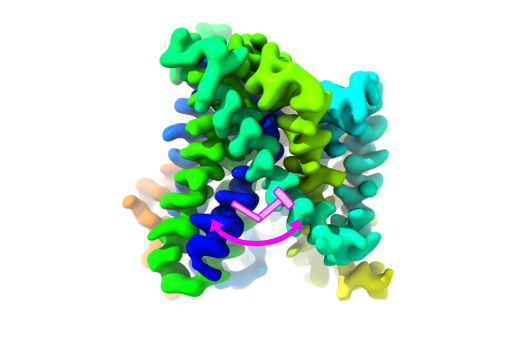
"Nuestro estudio sugiere que algunos ensamblajes de Aβ pueden perforar la membrana de las neuronas, alterar su equilibrio osmótico y, en consecuencia, desencadenar su muerte", explican Sonia Ciudad y Eduard Puig, primeros autores del artículo. Ciudad es alumni del IRB Barcelona, actualmente científica de I+D en Biokit, una empresa del grupo Werfen; mientras que Puig en la actualidad es investigador postdoctoral en el Laboratorio de Síntesis Asimétrica del IRB Barcelona.
Los poros de la membrana como objetivo para evitar la neurotoxicidad.
Este estudio ha destacado dos ensamblajes de proteínas Aβ, uno formado por cuatro proteínas Aβ y el otro por ocho, cuya estructura tiene la capacidad de alterar la membrana celular, señalándolos como posibles responsables de causar neurodegeneración en el Alzheimer.
El trabajo en adelante debería centrarse en prevenir la formación de este conjunto, evitando así la ruptura de la membrana. En la actualidad, los proyectos en marcha de descubrimiento de fármacos en este campo no incluyen ningún fármaco dirigido a estos ensamblajes de Aβ, por lo que este hallazgo podría lograr un avance significativo en el tratamiento de la enfermedad de Alzheimer.
Este trabajo fue financiado por el MINECO (SAF2015-68789), la Fundació La Marató de TV3 (20140730), la Fondation Recherche Médicale (AJE20151234751) y el Counseil Régional d’Aquitaine Limousin Poitou-Charentes (1R30117-00007559). Se llevó a cabo en colaboración con el laboratorio de Vladislav Orekhov en el Swedish NMR Centre, University of Gothenburg, Benjamin Bardiaux en el Institut Pasteur, Stéphane Chaignepain en CBMN, el laboratorio de Sarah Cianferani en la Universidad de Estrasburgo, el laboratorio de Giovanni Maglia en el Groningen Biomolecular Sciences & Biotechnology Institute y el laboratorio de Emad Tajkhorshid en el NIH Center for Macromolecular Modeling and Bioinformatics.
Artículo de referencia:
Sonia Ciudad, Eduard Puig, Thomas Botzanowski, Moeen Meigooni, Andres S. Arango, Jimmy Do, Maxim Mayzel, Mariam Bayoumi, Stéphane Chaignepain, Giovanni Maglia, Sarah Cianferani, Vladislav Orekhov, Emad Tajkhorshid, Benjamin Bardiaux & Natàlia Carulla.
Aβ(1-42) tetramer and octamer structures reveal edge conductivity pores as a mechanism for membrane damage
Nature Communications (2020) DOI:10.1038/s41467-020-16566-1
IRB Barcelona
El Instituto de Investigación Biomédica (IRB Barcelona) trabaja para conseguir una vida libre de enfermedades. Desarrolla una investigación multidisciplinar de excelencia para curar el cáncer y otras enfermedades vinculadas al envejecimiento. Establece colaboraciones con la industria farmacéutica y los principales hospitales para hacer llegar los resultados de la investigación a la sociedad, a través de la transferencia de tecnología, y realiza diferentes iniciativas de divulgación científica para mantener un diálogo abierto con la ciudadanía. El IRB Barcelona es un centro internacional que acoge alrededor de 400 científicos de más de 30 nacionalidades. Reconocido como Centro de Excelencia Severo Ochoa desde 2011, es un centro CERCA y miembro del Barcelona Institute of Science and Technology (BIST).