Images
Participants


















Contact

- La majoria de les oncoproteïnes humanes pertanyen a una classe de proteïnes anomenades “factors de transcripció”, però fins ara no s'havia aconseguit dissenyar medicaments per bloquejar-ne o amplificar-ne l'efecte.
- Un equip internacional d’investigadors liderat per l’IRB Barcelona ha descobert un nou enfocament per bloquejar la funció del receptor d’andrògens, un factor de transcripció clau en el càncer de pròstata, basat en la seva propensió a formar condensats.
- Els resultats descrits en aquesta publicació van establir les bases per a la creació de Nuage Therapeutics, spin-off d’IRB Barcelona i ICREA.
- Els resultats es publiquen a Nature Structural & Molecular Biology.
Els factors de transcripció són proteïnes reguladores que s'uneixen a l'ADN, que activen o desactiven gens i que controlen la velocitat a la qual es transcriu l'ADN a ARN missatger, necessari per a la síntesi de les proteïnes. A causa del seu paper central en el control de la formació de noves proteïnes, moltes malalties es poden atribuir a factors de transcripció desregulats.
Inhibir-ne l’activitat, especialment en el càncer, ofereix un potencial terapèutic, però molts factors de transcripció amaguen un as sota la màniga. Els dominis d'activació són intrínsecament desordenats, cosa que significa que no tenen una estructura tridimensional clara. La manca d’una estructura 3D estable fa pràcticament impossible dissenyar medicaments que s’uneixin als dominis d’activació.
Un equip liderat pels investigadors de l'IRB Barcelona Dr. Xavier Salvatella (Professor d’Investigació ICREA) i Dr. Antoni Riera (Professor de la Universitat de Barcelona), i pel Dr. Denes Hnisz, de l'Institut Max Planck de Genètica Molecular, i la Dra. Marianne D. Sadar, del BC Cancer (Universitat de British Columbia, Canadà), es va centrar en la tendència de les proteïnes intrínsecament desordenades a formar condensats moleculars. Van descobrir que els mecanismes involucrats en la condensació podrien ser utilitzats per inhibir l'activitat del receptor d'andrògens en el càncer de pròstata.
"La lògica que hem seguit per optimitzar un inhibidor del receptor d'andrògens podria ser explotada per inhibir altres factors de transcripció, la qual cosa obre noves possibilitats per abordar necessitats mèdiques no cobertes", explica el Dr. Salvatella, cap del laboratori de Biofísica Molecular de l'IRB Barcelona.
Els condensats, un nou enfocament per bloquejar els factors de transcripció
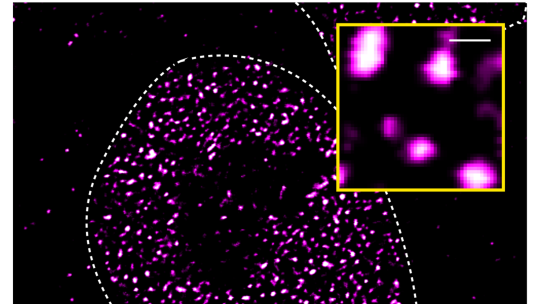
Sota el microscopi, els condensats moleculars semblen taques de proteïna surant en aigua. Els condensats es formen en un procés anomenat “separació de fases líquid-líquid”, semblant a com les gotes d'oli es fusionen quan es barregen en aigua.
"Havíem observat anteriorment que el receptor d'andrògens forma condensats moleculars quan s’afegeix fins i tot una petita quantitat d'una molècula activadora, com la testosterona, a les cèl·lules", explica el Dr. Shaun Basu, actualment Biòleg Computacional a Charité, i un dels primers autors de l'estudi, juntament amb la Dra. Paula Martínez-Cristóbal de l’IRB Barcelona.
Els científics van plantejar la hipòtesi que hi podria haver una connexió entre l'activació del receptor d'andrògens i la propensió a formar condensats. Al laboratori del Dr. Salvatella es van utilitzar tècniques de ressonància magnètica nuclear per identificar diversos fragments curts dins del domini d'activació intrínsecament desordenat que són essencials per a la separació de fases.
A més, aquests fragments curts també van ser necessaris per a la funció d'activació gènica del receptor. "Descobrim seqüències curtes en el domini d'activació que tendeixen a estar desordenades quan la proteïna és soluble, i sorprenentment, aquestes regions semblen formar hèlixs més estables quan la proteïna es concentra en condensats", afegeix el Dr. Hnisz. Les hèlixs curtes creen punts d'unió transitòria que poden ser l'objectiu d'inhibidors quan el receptor està en forma de condensats.
Millora en els compostos per al tractament del càncer de pròstata
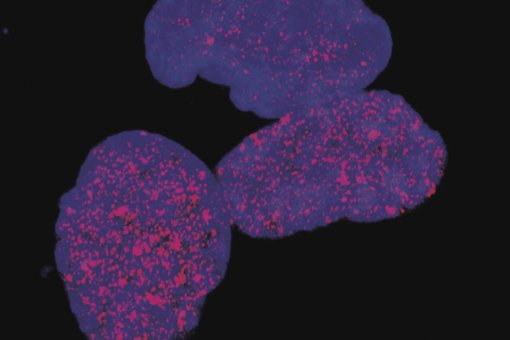
Treballant amb els laboratoris del Dr. Antoni Riera i de la Dra. Marianne Sadar, l'equip va millorar un inhibidor experimental de molècula petita per adaptar-se gairebé perfectament a aquests punts transitoris. Després, es van provar en models cel·lulars i de ratolins si aquests canvis augmentarien l'eficàcia en una forma agressiva i en una etapa avançada de càncer de pròstata.
"Vam modificar les característiques químiques del compost perquè coincidissin amb les característiques de la condensació del receptor d'andrògens, cosa que va resultar en un augment deu vegades més gran en la potència de la molècula en el càncer de pròstata resistent a la castració", explica la Dra. Paula Martínez-Cristóbal, també primera autora de l’estudi. "Això és realment important, perquè el càncer de pròstata resistent a la castració és extremadament agressiu i és resistent als tractaments actuals", afegeix.
Tot i això, els autors coincideixen que cal més investigació abans que aquests descobriments es tradueixin en teràpies noves i segures. L'equip espera que els mecanismes bàsics que ha descobert puguin aplicar-se a altres factors de transcripció, obrint la porta a dirigir-se a aquestes molècules importants en moltes malalties diferents. "Creiem que la idea que certes seqüències dins dels dominis de proteïnes intrínsecament desordenades adoptin una estructura transitòria estable en forma de condensats és probablement generalitzable a altres factors de transcripció", conclou el Dr. Hnisz.
L'empresa biotecnològica Nuage Therapeutics
Fundada pel Dr. Xavier Salvatella, el Dr. Mateusz Biesaga, el Dr. Denes Hnisz i la Dra. Judit Anido, l'empresa biotecnològica Nuage Therapeutics desenvolupa assajos de cribratge de fàrmacs dirigits a proteïnes intrínsecament desordenades que experimenten condensació biomolecular, proporcionant d’aquesta manera nous tractaments per a malalties que actualment es consideren difícils de tractar.
Els descobriments publicats a Nature Structural and Molecular Biology van establir les bases per a la fundació d'aquesta empresa el setembre del 2021. El potencial de la seva ciència va portar a una ronda de finançament inicial de 12 milions d’euros el juny del 2023.
Article relacionat:
Rational optimization of a transcription factor activation domain inhibitor
Shaon Basu#, Paula Martínez-Cristóbal#, Mireia Pesarrodona, Marta Frigolé-Vivas, Michael Lewis, Elzbieta Szulc, C. Adriana Bañuelos, Carolina Sánchez-Zarzalejo, Stasė Bielskutė, Jiaqi Zhu, Karina Pombo-García, Carla Garcia-Cabau, Levente Zodi, Hannes Dockx, Jordann Smak, Harpreet Kaur, Cristina Batlle, Borja Mateos, Mateusz Biesaga, Albert Escobedo, Lídia Bardia, Xavier Verdaguer, Alessandro Ruffoni, Nasrin R. Mawji, Jun Wang, Jon K. Obst, Teresa Tam, Isabelle Brun-Heath, Salvador Ventura, David Meierhofer, Jesús García, Paul Robustelli, Travis H. Stracker, Marianne D. Sadar*, Antoni Riera*, Denes Hnisz*, Xavier Salvatella*
Nature Structural & Molecular Biology (2023) DOI: 10.1038/s41594-023-01159-5
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).