Images
Participants



Contact

El grup de recerca de Natàlia Carulla ofereix dades que trenquen amb l’statu quo sobre el nombre d’unitats i la forma que adopten els primers agregats de la proteïna beta amiloide
El fenomen d’agregació de beta amiloide, procés pel qual aquesta proteïna s’enganxa amb ella mateixa, està fortament relacionat amb l’origen de l’Alzheimer
L’objectiu final de la línia de treball de Carulla és interceptar amb fàrmacs el procés d’agregació inicial com a estratègia per combatre la malaltia
Scientific Reports, revista del grup Nature, ha publicat recentment uns resultats que contradiuen els estudis publicats fins ara sobre el nombre d’unitats i la forma que adopten inicialment els agregats de beta amiloide, una proteïna estretament vinculada a l’origen i desenvolupament de la malaltia d’Alzheimer.
Liderat per la doctora especialitzada en química biomèdica, Natàlia Carulla, de l’Institut de Recerca Biomèdica (IRB Barcelona), el treball se centra en l’estudi dels primers agregats d’aquesta proteïna quan inicia el fenomen patològic d’enganxar-se amb altres unitats d’ella mateixa, procés que acaba amb les conegudes fibres de beta amiloide, components principals de les plaques observades en els cervells dels malalts d’Alzheimer. “Conèixer de forma fidedigna el nombre d’unitats i les conformacions de la beta amiloide quan comença a agregar-se és cabdal per poder dissenyar fàrmacs capaços de trencar-les o impedir que es formin”, explica Natàlia Carulla.
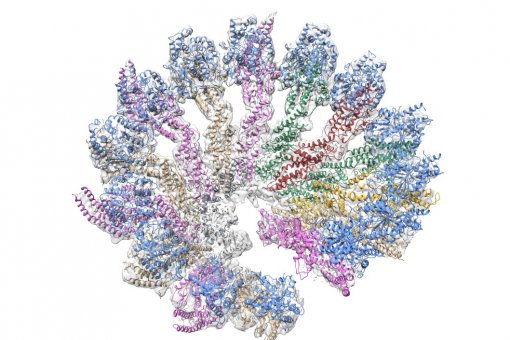
L’equip de l’IRB Barcelona ha estudiat l’agregació de les dues variants més comunes de la beta amiloide. La que té 40 aminoàcids, anomenada Abeta 40, i la de 42 aminoàcids, l’Abeta 42. Aquesta última és la que està més lligada a l’Alzheimer. La literatura diu que mentre l’Abeta 40 s’uneix amb ella mateixa formant seqüencialment dímers (dues unitats), trímers (tres unitats) i tetràmers (quatre unitats), l’Abeta 42 ho fa com a pentàmers (cinc unitats) i hexàmers (sis unitats). Aquests resultats han estat citats més de 1.000 vegades, i per tant molts estudis s’han fet a partir d’aquesta premissa acceptada. Per contra, el que han observat les investigadores de l’IRB Barcelona Rosa Pujol-Pina i Sílvia Vilaprinyó-Pascual, les dues primers signants de l’article, és que tant Abeta 40 com Abeta 42 passen exactament pels mateixos estadis d’agregació i adopten la mateixa estructura.
Els autors sostenen que els resultats assumits fins ara estan esbiaixats per la tècnica més àmpliament usada per obtenir estructures d’agregats de beta amiloide. La tècnica en discussió es coneix com a SDS-PAGE i està caracteritzada per necessitar molt poca quantitat de mostra i, per tant, fa els estudis més senzills. El grup de la Dra. Carulla, usant una tècnica nova basada en l’espectrometria de masses i la modelització computacional en col·laboració amb els equips de l’IRB Barcelona de Marta Vilaseca i Modesto Orozco respectivament, observa que tant Abeta 40 com Abeta 42 formen dímers, trímers i tetràmers i que, a més, en aquestes fases inicials adopten una forma globular, com d’esferes.
“Aquesta estructura que observem contradiu el tipus d’estructura prèviament descrita denominada de làmina beta. Fins ara el disseny de molècules s’ha basat en la premissa d’interferir amb una estructura de làmina beta. Creiem que caldria revisar aquesta estratègia i demanem cautela en usar la tècnica SDS-PAGE per estudiar oligòmers de beta amiloide”, afirma Sílvia Vilaprinyó-Pascual.
Els experiments d’agregació els han reproduït amb diverses tècniques, incloent SDS-PAGE. “Aquest treball generarà reticències de la comunitat i per això hem estat molt escrupolosos en presentar dades molt robustes metodològicament parlant”, diu Natàlia Carulla de l’IRB Barcelona.
A partir de les noves dades estructurals obtingudes, l’equip de Carulla està buscant molècules terapèutiques que evitin la formació dels primers agregats d’Abeta.
Article de referència:
SDS-PAGE analysis of Aβ oligomers is disserving research into Alzheimer´s disease: appealing for ESI-IM-MS
Rosa Pujol-Pina, Sílvia Vilaprinyó-Pascual, Roberta Mazzucato, Annalisa Arcella, Marta Vilaseca, Modesto Orozco & Natàlia Carulla
Scientific Reports (Oct 9) ;5:14809. doi: 10.1038/srep14809
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).